

注:AACR,成立于1907年,是世界上成立最早,规模最大的致力于全面、创新和高水准癌症研究的科学组织。
尽管我们在抗癌方面取得了令人难以置信的进步,但它仍然是美国乃至全世界面临的巨大公共卫生挑战,报告指出,到2040年,全球的癌症患者总数将达到2750万,并且有1630万患者因此去世。目前主要面临的挑战有以下几点:
不同的癌症,生存差距显著!
拿美国举例,癌症患者的5年生存率差异很大,主要取决于癌症类型和诊断阶段。例如,乳腺癌女性中,三阴性乳腺癌总体5年相对存活率为77%,而激素受体阳性超过90%;在肺癌的两种亚型中,非小细胞肺癌的总体5年相对存活率为24%,而小细胞肺癌仅为6%。此外,早期和晚期患者的生存率也存在巨大差异,在乳腺癌和结直肠癌患者中,早期患者5年存活率分别为99%和90%,而晚期仅分别为27%和14%。
人口增长和老龄化造成的癌症负担
在美国,预计新的癌症病例数和癌症死亡人数将逐年增加,到2040年分别达到230多万和近100万。预计这些数字的大幅上升的主要原因是人口增加和人口老龄化的增长。
癌症:昂贵的疾病,巨大的经济负担和影响
癌症不仅每年会夺去很多人的生命,还会通过巨大的经济的负担,让人感受到癌症的可怕,即便是在全球经济最发达的美国,癌症医疗保健支出在2017年高达1,612亿美元(26),这还不包括由于癌症相关的发病率和死亡所导致的生产力损失的间接成本。 6park.com
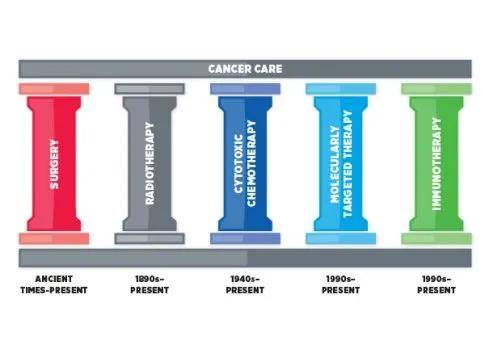
美国癌症研究协会最新公布:癌症治疗的五大重磅进展!癌症治疗的五大支柱都取得了突破性进展,包括:手术,放射疗法,细胞毒性化学疗法,分子靶向疗法和免疫疗法。
从2019年8月1日到2020年7月31日,FDA批准了20种用于治疗某些类型癌症患者的新疗法,同时,扩大了15种抗癌治疗药物的适应症,例如治疗其他类型癌症的治疗。全球肿瘤医生网医学部为大家整理了新增药物的表单,如果想申请其中新药的治疗,可以联系医学部评估是否符合免费用药条件。
01手术治疗
19世纪末以前,手术是治疗癌症患者的唯一方法,直至今日,手术仍是癌症治疗的第一大支柱,并且取得新的突破和进展,比如,一些患者在手术前可以接受放疗,化疗,靶向药或免疫药物等新辅助疗法,缩小肿瘤,为原本没有手术机会的患者创造机会,并提高手术安全性,增加复杂难治性肿瘤的治愈率。
02放射治疗
放射疗法在1896年成为癌症治疗的第二大支柱,临床中大约50%的患者需要接受放射治疗来缩小或消除肿瘤或防止局部复发。目前,立体定向消融放射治疗,调强放疗和质子质子是最先进的放疗技术,可以更精确地将放射线靶向肿瘤,避免肿瘤周围的健康组织受到放射线造成的损害,从而可以减少放射疗法的长期副作用。原文链接:“为癌而战”DAY1|关于放疗界顶配技术质子重离子,你想知道的都在这
03化疗
化疗是癌症治疗的第三大支柱。
细胞毒性化学疗法是第三种成为癌症治疗支柱的治疗方法(见图14)。如今,越来越多新型化疗药物能够提高患者生存率和生活质量。
小细胞肺癌-鲁比卡丁
1.2020年6月,小细胞肺癌新化疗药物-lurbinectedin(鲁比卡丁 Zepzelca)上市,打破了继拓扑替康后20年无药可用的沉积,客观缓解率与拓扑替康的16%相比增加到35%,翻了一倍多,给预后很差的小细胞肺癌患者带来了新的希望。原文链接:30年磨一剑!小细胞肺癌重磅新药lurbinectin获批上市!
尿路上皮癌-Jelmyto
2.2020年4月,FDA批准了一种新型的细胞毒性化疗丝裂霉素制剂-Jelmyto,用于治疗低级别上尿路尿路上皮癌患者。
这种新型的化疗方式提供了一种全新微创的方法来治疗低级别上尿路尿路上皮癌。与常规化疗不同这种药物是一种水凝胶,可以通过输尿管导管或肾造口术管将其给予患者,然后通过尿液排泄。临床数据显示,58%的患者在每六次凝胶治疗后能完全缩小肿瘤。
靶向治疗已经成为癌症治疗的第四大支柱。
在从2019年8月1日到2020年7月31日的12个月中,FDA批准了16种新的分子靶向抗癌药物,此外还有9种已上市的药物获得了新适应症的批准。下面的这张表格全面的总结了FDA过去一年中获批的新药物和新疗法,并总结出了各类癌症获批的重磅药物给大家参考。

不限癌种广谱抗癌药-Rozlytrek
2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药entrectinib上市,用于治疗具有NTRK融合物的12岁及以上患有实体瘤的成人和儿童患者以及ROS1阳性,转移性非小细胞肺癌(NSCLC)的成人。
这款药物的神奇之处在于不管肿瘤发生在什么部位,是否发生了转移,只要存在NTRK融合,就有可能快速起效,目前已发现NTRK融合存在于超过25类癌症中,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等,并且成人和儿童患者都可以使用。最新公布的在TRK融合癌患者的三项大型临床试验汇总数据显示,恩曲替尼的总缓解率ORR为57%,其中7.4%的患者完全缓解(肿瘤全部消退)。并且对于特定的人群,恩曲替尼的有效率能达到100%。
目前这款药物已经正式通过中国相关部门的审批正式开展临床试验,想申请的患者可以将基因检测报告,诊断报告电子版或拍照发送至doctor.huang@globecancer.com,邮件中留下联系方式,我们的专家将为您全面分析检测报告,匹配能够入组的临床试验,以及有无新药可以使用,收到报告分析完毕后一个工作日内电话联系。原文链接:新型抗癌药能治25种癌症!一半患者肿瘤缩小!国内有望上市
肺癌
ROS1-恩曲替尼
大约1%的患者会出现ROS1融合。
2019年8月批准以ROS1为靶点的治疗性恩替替尼作为转移性NSCLC患者的初始治疗,该患者测试涉及ROS1基因的染色体易位阳性。批准是基于I期和II期三期临床试验的结果,结果表明接受entrectinib的患者中有78%的患者肿瘤部分或完全缩小。同时entrectinib正在进行存在ROS1融合的其他类型癌症的患者,包括弥漫性桥脑神经胶质瘤等恶性实体肿瘤。强效抗脑转!肺癌新药Rozlytrek在国内开展临床试验!
MET-卡帕替尼
MET突变大概出现在3%~4%的非小细胞肺癌患者中,最常见的是外显子14部分缺失。
2020年5月,FDA批准了首个针对MET的治疗药物卡帕替尼(Tabrecta),用于治疗FoundationOne CDx检测到存在MET外显子14跳跃突变为阳性转移性NSCLC的患者。该批准基于II期临床试验的结果,该结果表明68%接受卡马替尼作为初始治疗的患者具有部分或完全的肿瘤缩小。在接受其他治疗后接受卡马替尼治疗的患者中,有41%的患者肿瘤部分或完全缩小。原文链接:非小细胞肺癌c-MET抑制剂双星已出世,下一个“明星”是谁?
RET-selpercatinib
有1-2%的非小细胞肺癌存在RET融合。
2020年5月,FDA批准了首个针对RET的治疗药物selpercatinib(Retevmo,LOXO-292),用于治疗RET融合阳性的转移性NSCLC的患者。该批准基于I / II期临床试验的结果,该结果表明接受selpercatinib作为初始治疗的患者中有85%的患者肿瘤部分或完全缩小。在铂类化疗后NSCLC进展的患者中,有64%的患者肿瘤部分或完全缩小。原文链接:提前获批!传奇抗癌药LOXO-292震撼上市,这三个问题一定要了解
乳腺癌
在美国,约有15%的乳腺癌特征为HER2阳性(363)。目前,有许多靶向HER2的疗法被批准用于治疗晚期或转移性HER2阳性乳腺癌。大多数患者首先接受曲妥珠单抗,另一种靶向HER2的治疗药物称为pertuzumab(Perjeta)联合化疗。
HER2-Fam-trastuzumab deruxtecan-nxki
2019年12月,FDA批准Fam-trastuzumab deruxtecan-nxki于用于治疗患有转移性HER2阳性乳腺癌的成年人,已经接搜2种或多种其他靶向HER2的治疗方案进行了治疗,但仍在进展。该批准基于II期临床试验的结果,该结果表明,接受推荐剂量的fam-trastuzumab deruxtecan-nxki的患者中,有超过60%的患者出现了部分或完全的肿瘤缩小。
HER2-图卡替尼
2020年4月,FDA批准Tucatinib(图卡替尼)与曲妥珠单抗和细胞毒性化疗卡培他滨联用,治疗晚期或转移性HER2阳性乳腺癌的成人,已经用一种或多种其他靶向HER2的疗法进行了治疗。其批准是基于一项II期临床试验的结果,该结果表明在曲妥珠单抗和卡培他滨中加入图卡替尼显着提高了中位总体生存率,对于难治的脑转移患者,接受图卡替尼治疗的患者中位疾病进展时间明显更长。原文链接:喜讯!图卡替尼提前四个月获批,晚期乳腺癌患者迎来重磅新药!
三阴乳腺癌-Trodelvy
有10%的患者为三阴性乳腺癌,这是预后最差的一种乳腺癌,。
2020年4月,FDA批准了一种称为sacituzumab govitecan-hziy(Trodelvy)的抗体-药物偶联物,用于治疗患有转移性三阴性乳腺癌的成年人,患者接受至少两种其他治疗方案,但该疾病已经进展。Sacituzumab govitecan-hziy在I / II期临床试验中显示可使33%接受抗体-药物偶联物的患者引起部分或完全肿瘤缩小,这款药物显著改善了三阴乳腺癌患者的预后。原文链接:逆转生存期!四大新型药物为三阴乳腺癌打开长生存大门!
胰腺癌
胰腺癌是最致命的癌症之一,五年生存率仅为9%。有4%至7%的患者存在遗传性BRCA1 / 2突变。
BRCA-Lynparza
在2019年12月,FDA批准了针对PARP的治疗药物奥拉帕尼(Lynparza)用于治疗转移性胰腺癌的患者,这些患者在以铂类为基础的化疗方案进行一线治疗期间未进展,并且具有遗传的BRCA1 / 2突变。该批准基于III期临床试验的结果,该结果表明,用olaparib治疗几乎使疾病进展的中位时间延长了一倍(361)。接受olaparib的患者无进展生存期为7.4个月,而接受安慰剂的患者为3.8个月。原文链接:柳叶刀重磅!生存期延长一年以上!基因检测让晚期胰腺癌患者突破生存绝境
胃肠间质瘤
胃肠道间质瘤(GIST)是出现在胃肠道的任何地方的一种肉瘤。大多数GIST存在KIT基因或PDGFRA基因突变,2002年,伊马替尼(Gleevec)成为被FDA批准用于治疗GIST的首个靶向疗法。
PDGFRA外显子18突变-Ayvakit
2020年1月,FDA批准了avapritinib(Ayvakit)用于治疗具有转移性或不可切除GIST的成人,PDGFRA外显子18突变(包括D842V突变)呈阳性。该批准基于I期临床试验的结果,该结果表明89%的D842V突变GIST的患者肿瘤已完全或部分缩小。
KIT-Qinlick
2020年5月,FDA批准了利培替尼(Qinlick)用于治疗晚期GIST的成年人。三期临床试验中显示与安慰剂相比显着延长疾病进展的时间,这些患者已经接受了三种或以上靶向疗法仍进展的极晚期患者。
肝内胆管癌
20%的肝内胆管癌患者存在FGFR2基因突变。
FGFR2-Pemigatinib
2020年,FDA批准Pemigatinib用于治疗以前曾治疗过,无法切除的局部晚期或转移性FGFR2阳性胆管癌的成年人。该批准基于II期临床试验的结果,该结果表明,使用Pemigatinib治疗可使36%的患者完全或部分缩小肿瘤。
癌症免疫治疗通过释放患者免疫系统的能力来对抗癌症,肿瘤的免疫治疗虽发展晚,却以前所未有的速度进入临床,近年来,它已成为癌症治疗的第五大支柱,并有望最终成为治愈肿瘤的重要武器。
免疫治疗之所以令全球的科学家振奋,其中一部分原因是因为一些接受过这些革命性抗癌治疗的非常晚期的转移性疾病患者也能够获得显着和持久的反应。例如,pembrolizumab(Keytruda)作为晚期NSCLC患者初始治疗的临床试验的长期结果显示,23%的患者生活了5年或更长时间,而既往晚期NSCLC患者的生存率不足5%。再比如白血病女孩艾米莉已被CAR-T细胞疗法成功治愈8年,她也成为这一史诗级疗法的代言人被载入史册。
我们一起看下过去一年又有哪些新批准的免疫疗法给病友们带来生存奇迹。
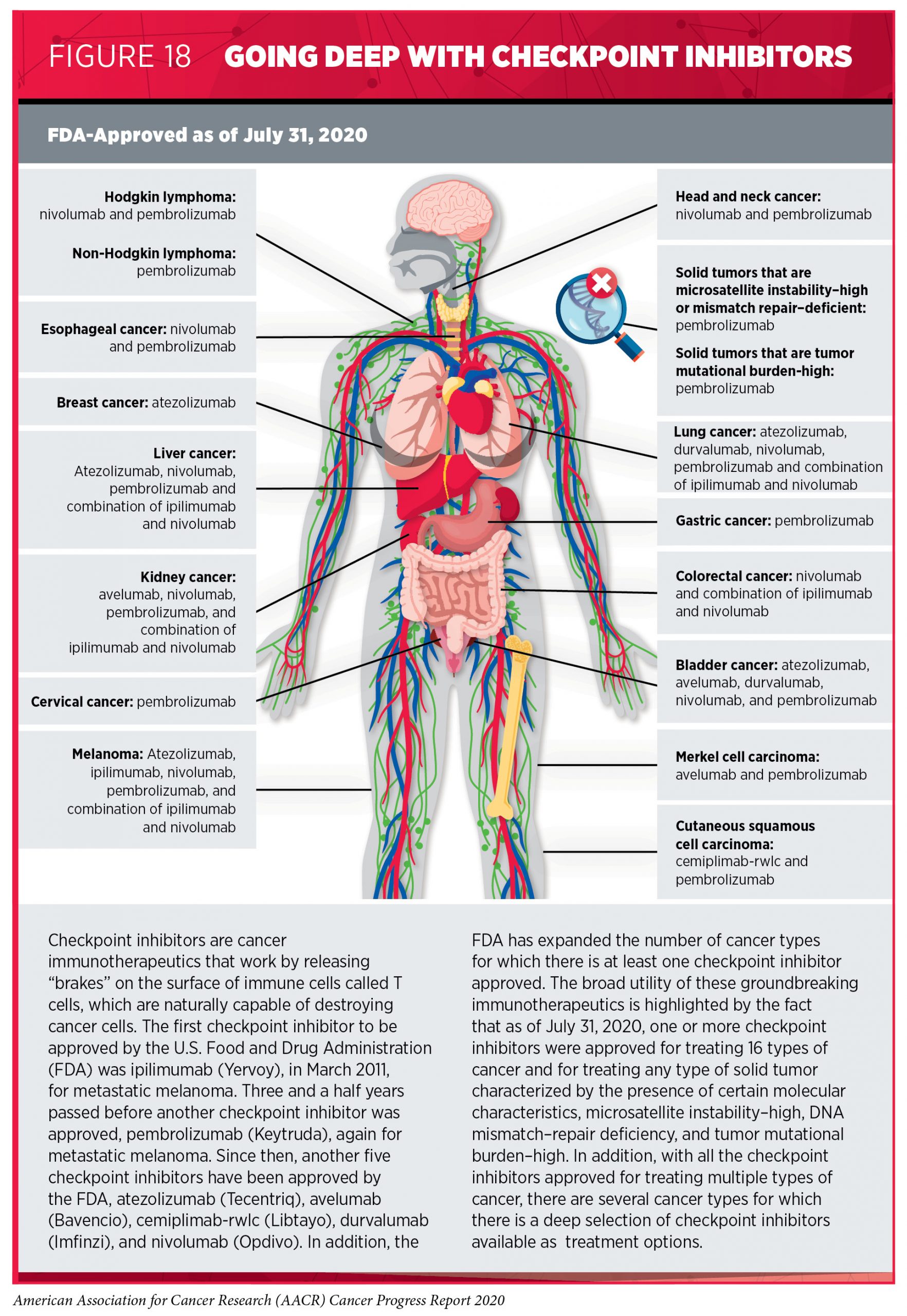
免疫检查点抑制剂
截至2020年7月31日,共有10种FDA批准的检查点抑制剂疗法。
Keytruda-TMB实体瘤
2020年6月,FDA批准pembrolizumab治疗具有高组织肿瘤突变负荷(TMB-H)≥10个突变/兆碱基(使用FDA指定的检测)的无法切除或转移性实体瘤的成年和儿科患者。批准是基于来自II期临床试验的数据,使用pembrolizumab治疗可使30%的具有不可切除或转移性肿瘤缩小。原文链接:批了!Keytruda第二项不限癌种适应症获批上市!
Keytruda-MSI-H结直肠癌
2020年6月,FDA批准使用派姆单抗(KEYTRUDA,Merck&Co.)作为一线治疗不可切除或转移性微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)大肠癌的患者,该批准基于II期临床试验的结果,该结果表明,与接受标准治疗的患者相比,接受pembrolizumab的患者疾病进展之前的时间几乎翻了一番。
Keytruda-子宫内膜癌
2019年9月,FDA批准pembrolizumab与lenvatinib(Lenvima)联合治疗晚期子宫内膜癌,在经过先前的全身性治疗后疾病进展但不适合使用根治性手术或放射治疗的患者。批准是基于I / II期临床试验的数据,该数据表明pembrolizumab和lenvatinib治疗可使40%的患者肿瘤缩小。
Keytruda-皮肤鳞状细胞癌
在2020年6月,FDA批准pembrolizumab用于皮肤鳞状细胞癌治疗,此次批准是基于一项II期临床试验的结果,该研究表明,接受免疫治疗的患者中有34%的患者肿瘤完全或部分缩小。
durvalumab-小细胞肺癌
2020年3月,FDA批准durvalumab联合依托泊苷和卡铂/顺铂联合用于某些晚期SCLC患者的初始治疗。该批准基于III期临床试验的结果,该结果表明在标准细胞毒性化学疗法中添加durvalumab可以改善总体生存率。
nivolumab-食管鳞状细胞癌
2020年6月,FDA批准nivolumab治疗化疗后进展的食管鳞状细胞癌的晚期复发性或转移性成人患者。该批准基于III期临床试验的结果,其中表明与标准化疗相比,nivolumab改善了总生存期。
nivolumab-肝癌
2020年3月,FDA批准将nivolumab与ipilimumab联合使用来治疗肝细胞癌患者,在I / II期临床试验中显示该药物可使33%的标准治疗失败的患者肿瘤缩小。
nivolumab-非小细胞肺癌
2020年5月,FDA批准将nivolumab与ipilimumab联合使用治疗PD-L1阳性的非小细胞肺癌。
atezolizumab-肝癌
2020年5月,FDA批准atezolizumab联合贝伐单抗(Avastin)治疗无法通过手术的转移性肝细胞癌初始治疗方法。
atezolizumab-黑色素瘤
2020年7月,FDA批准atezolizumab联合cobimetinib(Cotellic)和vemurafenib(Zelboraf)治疗BRAF V600阳性的黑色素瘤。批准是基于一项III期临床试验的结果,该研究表明,将atezolizumab添加到cobimetinib和vemurafenib中会显着增加疾病进展的时间。
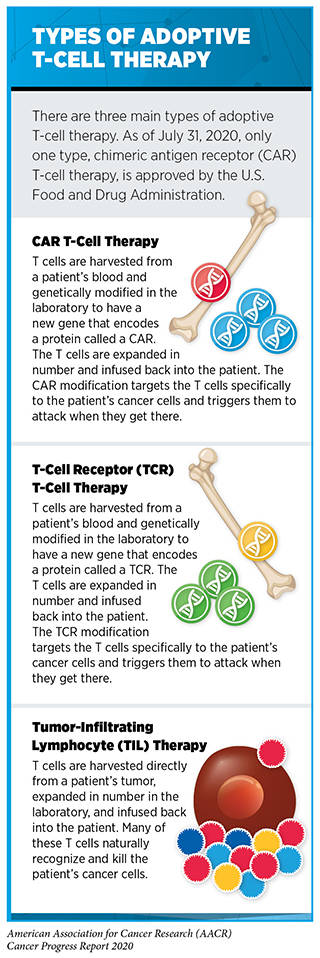
过继性细胞免疫疗法
大幅增加患者体内的能杀死癌细胞的T细胞数量是最新研发的称为过继性T细胞治疗的免疫治疗方法(418)。这种疗法需要先从患者体内收集T细胞,在实验室中进行扩增和/或基因改造,然后回输到患者体内,攻击并消灭癌细胞。
2020年7月,FDA批准了第三种过继性T细胞疗法,即brexucabtagene autoleucel(Tecartus)用于治疗套细胞淋巴瘤。批准是基于II期临床试验的结果,该结果表明接受brexucabtagene的患者中有60%以上具有完全反应。

未来,癌症治愈终将成为现实!癌症研究处在一个令人兴奋时代。近年来在癌症基因组学和免疫学研究的发现成功建立起了癌症治疗的两大支柱——靶向疗法和免疫疗法。它们为更多不同类型的癌症患者造福。
随着这些新型抗癌药物、疫苗和不断开发中的单克隆抗体研究,将被称为“绝症”的晚期癌症变为一种慢性疾病,从根本上改变对癌症治疗的观念。我们期待,从现在起20年后,人类能够接种疫苗来预防癌症,战胜癌症,相信这一天离我们不远了!
| 欢迎光临 建锋网络论坛 (http://forum.kensoft.com/) | Powered by Discuz! 6.0.0 |